Recolectamos información sobre las sales, bases y ácidos para así informarnos
sobre los fundamentos de la química inorgánica.
 |
| Ejemplo: Ácido clorhídrico, Hidróxido de potasio, y Cloruro de potasio |
Contenido
1.) Introducción2.) Objetivos:
-Objetivo general
-Objetivos específicos
3.) Justificación
4.) Marco teórico
5.) Desarrollo del laboratorio
6.) Conclusiones
7.) Webgrafia
Introducción
En esta entrada el lector podrá informarse acerca de las sales, bases o también llamado hidróxidos y por ultimo los ácidos, sabrá como se forman,sus principales características,su clasificación y nomenclatura, puede observar como se llevó a cabo el laboratorio sobre el tema en un excelente software denominado ''Yenka'', también se informara sobre la neutralización, titulación y la determinación del pH, para finalizar podrá disfrutar de unos vídeos donde podrá aumentar su conocimiento previo y adquirido, por ultimo puede conocer las conclusiones para realizar un repaso de los temas aprendidos.
Objetivos
Objetivo general:
Relacionarse con las sales,bases y ácidos, reconociendo como los elementos químicos se mezclan para formar estas sustancias,para así entender su formación y nomenclatura.
- Reconocer el concepto y clasificación de las bases, ácidos y sales.
- Conocer las nomenclatura químicas : Stock, sistemática y común o tradicional.
- Saber identificar las principales características, semejanzas y diferencias.
Justificación
Esta entrada se realizo para facilitar el aprendizaje sobre el tema a usuarios de la red, estudiantes y docentes,para brindarles una herramienta para enseñar. También se realizo recordar la importancia de las sales, bases y ácidos como elementos de limpieza, aditivos para alimentos, medicinas, ademas del papel que presenta en el estomago y su acidez. Ademas de reconocer como se realiza la formación o composición de estos, donde posteriormente reciben un determinado nombre a través de las tres nomenclaturas químicas.
Marco teórico
Nomenclatura química
-Función química: Es el conjunto de propiedades comunes que caracterizan una serie de sustancias, lo cual permite diferenciarlas de las demás.
-Grupo funcional: La diversas especies que tienen una función química determinada, poseen en su molécula un átomo o grupo de átomos de constitución análoga que la caracteriza, por ejemplo, hidróxido se identifica por su grupo funcional OH (Hidroxilo).
Óxidos
Un óxido es un compuesto binario que contiene uno o varios átomos de oxígeno, presentando el oxígeno un estado de oxidación -2, y otros elementos. Hay óxidos que se encuentran en estado gaseoso, liquido o sólidos a temperatura ambiente.
Ejemplo:
- CaOÓxido de Calcio (Cal)
- MnO2 Óxido de Manganeso
- K2O Óxido de Potasio
- Na2O2 Peróxido de Sodio
- Ag2O Óxido de Plata
- Cu2O Óxido de Cobre (I)
- CuO Óxido de Cobre (II)
Óxidos básicos o metálicos: Un óxido básico es un compuesto que resulta de la combinación de un elemento metal con el oxígeno.
Fórmula
|
Tradicional
|
Iupac
|
Stock
|
Ca O
|
Monóxido de calcio
|
óxido de calcio
| |
Cu2O
|
Monóxido de dicobre
| ||
Cu O
|
Monóxido de cobre
| ||
Fe O
|
Monóxido de hierro
| ||
Fe2O3
|
Trióxido de hierro
|
Propiedades :
-Óxido metálico= Óxido básico= reacción con agua pura “hidróxidos”.
-Son compuestos con elevado punto de fusión, los cuales se forman como consecuencia de la reacción de un metal con el oxigeno.
- Las bases se pueden reconocer fácilmente por un cambio de color en un indicador “Ácido-básico”.
Óxidos ácidos o no metálicos: Un óxido ácido es un compuesto químico binario que resulta de la combinación de un elemento no metal con el oxígeno.
Como se forman: Los óxidos ácidos son los formados con un no metal + oxígeno, los óxidos de elementos más electronegativos tienden a ser ácidos. Se les llaman también anhídridos
| Formula | Tradicional | Iupac | Stock |
| Cl2O | Anhídrido hipocloroso | Monóxido de dicloro | Óxido de cloro (I). |
| Cl2O3 | Anhídrido cloroso | Trióxido de dicloro. | Óxido de cloro (III). |
| Cl2O5 | Anhídrido clórico | Pentóxido de dicloro | Óxido de cloro (V). |
| Cl2O7 | Anhídrido perclórico | Heptóxido de dicloro | Óxido de cloro (VII). |
Propiedades :
- Son compuestos de bajos puntos de fusión los cuales se forman al reaccionar un no metal con el oxigeno.
- Cuando los ácidos no metálicos reaccionan con el agua forman ácidos.
- Los ácidos se pueden reconocer por el cambio de un indicador “ácido-base”.
- los ácidos producidos por la reacción de los óxidos no metálicos con el agua se denominan oxácidos por el oxigeno contenido.
Nomenclaturas
La nomenclatura química es el conjunto de reglas que se usan para nombrar las
combinaciones existentes entre los elementos y los compuestos químicos.
-Nomenclatura de stock: Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”. La valencia (o número de oxidación) es el que indica el número de electrones que un átomo pone en juego en un enlace químico.
Bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + de + nombre del elemento específico + el No. de valencia.
Ejemplos:
1. Cu2O Óxido de Cobre (I)
2. CuO Oxido de Cobre (II)
3. PbO2 Oxido de plomo (IV)
4. CaO Oxido de Calcio
5. I2O7 Oxido de Iodo (VII)
6. Cl2O Oxido de Cloro (I)
7. Cl2O3 Oxido de Cloro (III)
8. Cl2O5 Oxido de Cloro (V)
-Nomenclatura tradicional, clásica o funcional: En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” y en algunos casos se puede optar a usar el sufijo –ico.
-
- K2O, óxido de potasio u óxido potásico.
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
-
- … -oso cuando el elemento usa la valencia menor: Fe+2O-2, hierro con la valencia +2, óxido ferroso
- … -ico cuando el elemento usa la valencia mayor: Fe2+3O3-2, hierro con valencia +3, óxido férrico2
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
-
- hipo- … -oso (para la menor valencia)
- … -oso (para la valencia intermedia)
- … -ico (para la mayor valencia)
- Cuando entre las valencias se encuentra el 7 se usan los prefijos y sufijos.
-
- hipo- … -oso (para las valencias 1 y 2)
- … -oso (para las valencias 3 y 4)
- … -ico (para las valencias 5 y 6)
- per- … -ico (para la valencia 7)
- Ejemplo:
- 1. Cl2O (óxido de cloro)
- 2. SO2 (óxido sulfuroso)
- 3. SO3 (óxido sulfúrico)
- 4. CO (óxido carbonoso)
- 5. CO2 (óxido carbónico).
6. CuO (óxido cúprico) - 7. Cu2O (óxido cuproso)
- 8. FeO (óxido ferroso)
- -Nomenclatura sistemática o IUPAC : También llamada racional o estequiométrica. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula.
- La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico.
| Prefijos griegos | número de átomos |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| oct- | 8 |
| non- nona- eneá- | 9 |
| deca- | 10 |
- CO2 (dióxido de carbono)
- CO (monóxido de carbono)
- SO2 (dióxido de azufre)
- SO3 (trióxido de azufre)
- Fe2O3 (trióxido de dihierro)
- Cu2O (monóxido de dicobre)
- CuO (monóxido de monocobre)
Hidróxidos o base
Es el resultado de una combinación de un oxido metálico (oxido básico) con agua. Los hidróxidos son compuestos ternarios (es decir, constituidos por tres elementos) : un metal, oxigeno e hidrógeno se encuentran formando uno o mas grupos OH (grupos hidroxilo), por lo que estos compuestos siempre tienen el mismo numero de oxigeno que de hidrógeno.
Propiedades:
- Crean sustancias que aceptan o reciben protones.
- Resultan de la combinación de un óxido básico con el agua.
- Son sustancias que en solución producen iones de hidroxilo.
- Son electrolitos (conducen la corriente eléctrica).
- Los hidróxidos solubles en agua, cuando entran en contacto con ella, liberan aniones dehidroxilo.
- Presentan un sabor amargo.
- Son cáusticos para la piel y para nuestro organismo.
Ejemplo:
1. Hidróxido cúprico Cu(OH)
2. Hidróxido de aluminio Al(OH)3
3. Hidróxido de amonio NH4OH
4. Hidróxido de bario Ba(OH)2
5. Hidróxido de calcio Ca(OH)2
6. Hidróxido de estroncio (Sr(OH)2)
7- Hidróxido de litio LiOH
Ácidos
Los ácidos son compuestos que presentan en su estructura molecular uno o más átomos de hidrógeno, los cuales al disolverse en el agua se liberan en forma de catión H+ llamado: ión hidrógeno, protón o hidrogenón.
Propiedades:
- Enrojecen al papel tornasol.
- Incoloran la solución de fenolftaleina en un medio ácido.
- Neutralizan los hidróxidos o bases.
- Tienen sabor agrio.
- Corroen metales.
- Ceder portones o iones hidrógeno (H) en medio acuoso.
Ácidos hidrácidos:
Son compuestos binarios que forma el hidrógeno por combinación quimica con elementos no metálicos de los grupos VIA (S, Se, Te) y del grupo VIIA (F, Cl, Br, I); por lo tanto no poseen oxígeno en su molécula.
La nomenclatura tradicional establece que se coloque el nombre genérico ácido seguido del nombre del no metal terminando en el sufijo hídrico (más usado en solución acuosa).
La nomenclatura sistemática emplea el sufijo uro para nombrar el anión y a continuación se nombra el catión.
| Formulación | Fórmula | N. Tradicional | N. Sistemática |
| H+1 S-2 | H2S | ácido sulfhídrico | sulfuro de hidrógeno |
| H+1 Se-2 | H2Se | ácido selenhídrico | seleniuro de hidrógeno |
| H+1 Te-2 | H2Te | ácido telurhídrico | teleruro de hidrógeno |
| H+1 F-1 | HF | ácido fluorhídrico | fluoruro de hidrógeno |
| H+1 Cl-1 | HCl | ácido clorhídrico | cloruro de hidrógeno |
Ácidos oxácidos:
Son compuestos ternarios, en general se obtienen por reacción química de un oxido ácido (anhídrido) y el agua. Se diferencian de los hidrácidos en que estos no poseen oxígeno y los oxácidos si poseen oxígeno.
Anhídrido+ H2O → oxácido
Ejemplos:
1. Ácido sulfúrico (S = 2 , 4 , 6)
SO3 (anhídrido sulfúrico) + H2O → H2SO4
2. Ácido bromoso (Br = 1, 3, 5, 7)
Br2O3 (anhídrido bromoso) + H2O → 2 HBrO4
3. Ácido hipoteluroso (Te = 2, 4, 6)
TeO (anhídrido hipoteluroso) + H2O → 2 H2TeO2
Clasificación de los oxacidos:
1. Polihidratados: Los óxidos ácidos de ciertos no metales pueden combinarse con mas de una molécula de agua, para diferenciarlos se utilizan los prefijos: piro, meta y orto; según la siguiente tabla:
| Prefijo | Elemento – valencia impar | Elemento – valencia par |
| meta | 1 anhidrido + 1 H2O | 1 anhidrido + 1 H2O |
| piro | 1 anhidrido + 2 H2O | 2 anhidrido + 1 H2O |
| orto | 1 anhidrido + 3 H2O | 1 anhidrido + 2 H2O |
Ejemplos:
- Ácido pirocarbonoso (C = 2 , 4) , valencia par
2 CO + H2O → H2C2O3
- Ácido ortofosfórico (P = 1, 3, 5)
P2O5 (anhidrido bromoso) + 3 H2O → H6P2O8 → H3PO4
2. Poliácidos: Se caracterizan porque sus moléculas poseen 2 o más átomos del no metal por lo cual se usan en la nomenclatura clásica, prefijos: di, tri, tetra, etc., delante del no metal cuando el ácido posee dos, tres, cuatro átomos no metálicos respectivamente..
Obtención general:
“n” anhidrido + H2O → poliácido
Ejemplos:
- 2 Cl2O3 + H2O → H2Cl4O7 : ácido tetraclórico
- 2 SO3 + H2O → H2S2O7 : ácido disulfúrico
3. Peroxiácidos ( peroxoácidos): Se caracterizan porque poseen 1 átomo de oxígeno más que el oxácido correspondiente. En su nomenclatura se utiliza el prefijo peroxi o peroxo y solo son estables para el estado de oxidación mas alto del no metal.
Estructuralmente, se considera que los peroxiácidos resultan de sustituir átomos de oxígeno (O-2) del oxácido correspondiente por el grupo peróxido (O2-2)
Formulación práctica:
Oxácido + O → peroxácido
Ejemplos:
- H2SO4 (ácido sulfúrico) + O → H2SO5 : ácido peroxisulfúrico
- H2S2O7 (ácido disulfúrico) + O → H2S2O8 : ácido peroxidisulfúrico
4. Tioácidos: Son compuestos que derivan de los oxácidos por sustitución de 1 o mas átomos de oxígeno por igual número de átomos de azufre.
Ejemplos:
- HClO2 (ácido cloroso) → HClOS : ácido tiocloroso ( sustitución de 1 “O” por 1 “S”)
- H2SO4 (ácido sulfúrico) → H2S3O2 : ácido ditiosulfurico ( sustitución de 2 “O” por 2 “S”)
- H2CO3 (ácido carbónico) → H3CS3 : ácido sulfocarbónico ( sustitución de “O” por “S”)
Acidos especiales: Son compuestos cuya formulación y nomenclatura son muy particulares, los cuales principalmente participan en la formación de iones y compuestos complejos y también poseen las propiedades típicas de los ácidos.
| Fórmula | Nomenclatura clásica |
| HCN | ácido cianhídrico |
| HCNO | ácido ciánico |
| HCNS | ácido tiociánico |
| H3Fe (CN)6 | ácido ferricianhídrico |
| H4Fe (CN)6 | ácido ferrocianhídrico |
| HN3 | azida de nitrógeno |
Sales
Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión y el ácido el anión.
Propiedades:
-Son sólidos cristalinos.
-Tienen elevadas temperatura de ebullición y fusión.
-En estado solido solido, los compuestos ionicos no conducen la electricidad.
-Al fundirse o disolverse, se rompe la estructura cristalina,los iones quedan libres y pueden conducir la electricidad.
-En general son solubles,lo son en disolventes como el agua, pero no en disolventes como la gasolina, el benceno o el tetracloruro de carbono.
La nomenclatura:
OXIDO SAL
Terminación Ico-----------Ato
Terminación Oso----------Ito
Terminación Hidrico------Uro
Se clasifican en sales neutras o ácidas, según contengan o no hidrógeno en sus moléculas.
Las sales neutras: Las sales binarias son combinaciones de 2 elementos distintos del hidrógeno y del oxígeno. La unión de un elemento metálico con un elemento no metálico forman una sal neutra, mientras que la unión de un elemento no metálico con otro elemento no metálico forman una sal volátil.
Ejemplo:
- Li+1 + F-1 » LiF: fluoruro lítico
- Ti+3 + F-1 » TiF3: fluoruro titanioso
- Ni+3 + F-1 » NiF3: fluoruro niquélico
- U+3 + F-1 » UF3: fluoruro hipouranioso
- Au2S: sulfuro de oro (I)
- FeBr3: bromuro de hierro (III)
- Au2S: monosulfuro de dioro
- Au2S3: trisulfuro de dioro
Las sales ácidas: Las sales ácidas se forman por la reacción de un hidróxido y un ácido, pero a diferencia de en las sales neutras solo se produce una neutralización parcial de los hidrogeniones del ácido. Es necesario que los ácidos tengan más de un hidrógeno para formar estas sales (polipróticos).
Ejemplo:
- H3PO4 + 3 NaOH → Na3 PO4 + 3 H2O sal neutra, se forman 3 moléculas de agua neutralizándose los 3 H+ del ácido
- H3PO4 +2 NaOH → Na2 HPO4 + 2 H2O sal mono-ácida, se forman 2 moléculas de agua neutralizándose 2 H+del ácido.
- H3PO4 + 1 NaOH → Na H2 PO4 + H2O sal di-ácida, se forma 1 molécula de agua neutralizándose 1 H+ del ácido.
La titulación
La titulación es un procedimiento utilizado en química con el fin de determinar la molaridad de un ácido o una base . Una reacción química se establece entre un volumen conocido de una solución de concentración desconocida y un volumen conocido de una solución con una concentración conocida .
Un equivalente ácido es igual a un mol de H + o iones H3O + . Del mismo modo , un equivalente base es igual a un mol de iones OH- .
Ejemplo:
HCl + NaOH = NaCl + H2O
Como podemos observar la reacción de neutralización produce una sal (NaCl) y agua, notándose el producto iónico de esta en los reactivos usados
Como podemos observar la reacción de neutralización produce una sal (NaCl) y agua, notándose el producto iónico de esta en los reactivos usados
La neutralización
La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua.
La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
Ejemplo:
Se consumieron 60 ml de NaOH 0,4 M contra un volumen de H2SO4 en el erlenmeyer de 100 ml.
Los moles agregados de NaOH son:
0,4 M x 0,060 litros: 0,024 moles
Según la reacción, la cantidad de moles de NaOH es el doble del H2SO4: Entonces de H2SO4 habrán 0,012 moles. La molaridad de H2SO4 será:
M = 0,012 moles / 0,1 litro (100 ml)
M = 0,12 M
M = 0,12 M
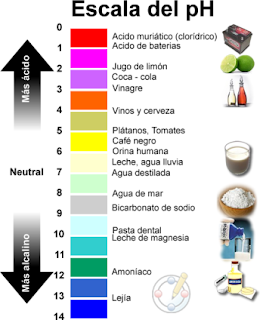
La determinación del pH
El pH puede definirse como una medida que expresa el grado de acidez o basicidad de una solución en una escala que varía entre 0 y 14 (fig.1). La acidez aumenta cuando el pH disminuye. Una solución con un pH menor a 7 se dice que es ácida, mientras que si es mayor a 7 se clasifica como básica. Una solución con pH 7 será neutra.
El valor del pH se puede medir de forma precisa mediante un potenciómetro, también conocido como pH-metro (/pe achímetro/ o /pe ache metro/), un instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo de referencia (generalmente de
plata/cloruro de plata) y un electrodo de vidrio que es sensible al ion de hidrógeno.
Disociación
Es el proceso , en el cual compuestos complejos, sales u otras moléculas se ven separadas en moléculas de menos tamaño, ya sean estas iones o radicales, generalmente de manera reversible. Por lo cual, podemos decir que la disociación es justo lo contrario de asociación, síntesis, formación o recombinación.
Desarrollo del laboratorio
Conclusiones
-Los óxidos se forman a partir de la combinación de oxigeno y un elemento metal,se denominaría oxido básico y al mezclarse con un no metal se llama oxido ácido.
-Cuando un oxido básico se mezcla con agua (H20) el compuesto resultante se denomina hidróxido o base.
-Cuando un oxido ácido se combina con agua da lugar a un ácido.
-La combinación entre hidróxido y ácido se denomina sal.
-Los hidracidos son combinaciones de elementos del grupo VII y VI con hidrógeno.
-Los oxacidos son mezclas de de hidrógeno,oxigeno y elementos no metales.
Webgrafia
http://tareassbuenass.blogspot.com.co/2012/02/oxidos-basicos-y-oxidos-acidos.html
http://adairpescador.blogspot.com.co/2011/11/caracteristicas-de-oxidos-bases-y.html
http://definicion.de/nomenclatura/
https://es.wikipedia.org/wiki/Nomenclatura_qu%C3%ADmica_de_los_compuestos_inorg%C3%A1nicos#Sistema_Stock
http://es.slideshare.net/monik17marcela16/hidroxidos-o-bases
http://www.buenastareas.com/ensayos/Propiedades-De-Los-Oxidos-Hidroxidos-Sales/5043225.html
http://www.fullquimica.com/2011/09/funcion-acido.html
http://es.slideshare.net/karlau2dm/propiedades-de-las-sales-16980766
http://www.formulacionquimica.com/sales-neutras/
http://www.quimicayalgomas.com/quimica-general/neutralizacion-acido-base/














No hay comentarios:
Publicar un comentario