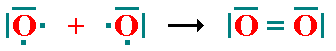PANTALLAZO LIKE DEL VIDEO CENTINELAS
¡Eureka!
martes, 9 de agosto de 2016
viernes, 20 de mayo de 2016
jueves, 10 de marzo de 2016
jueves, 25 de febrero de 2016
INFORMES SOBRE LOS VIDEOS
Ubicación del grupo VII-A en la tabla periódica
El nombre de halógeno proviene del griego que significa formadores de sales. Los elementos que forman este grupo son flúor, cloro, bromo, yodo y astato (F, Cl, Br, I y At).
externa ns2 np5
Símbolo F, número atómico 9, miembro de la familia de los halógenos con el número y peso atómicos más bajos. Aunque sólo el isótopo con peso atómico 19 es estable, se han preparado de manera artificial los isótopos radiactivos, con pesos atómicos 17 y 22, el flúor es el elemento más electronegativo, y por un margen importante, el elemento no metálico más energético químicamente.
Propiedades:
El estado del flúor en su forma natural es gaseoso (no magnético). El flúor es un elmento químico de aspecto gas pálido verde-amarillo y pertenece al grupo de los halógenos. El número atómico del flúor es 9. El símbolo químico del flúor es F. El punto de fusión del flúor es de 53,53 grados Kelvin o de -218,62 grados celsius o grados centígrados. El punto de ebullición del flúor es de 85,03 grados Kelvin o de -187,12 grados celsius o grados centígrados.
Propiedades:
1. Su principal propiedad general es que son muy reactivos, ya que forman haluros con muchos compuestos químicos en especial con el hidrógeno.
2.Presentan los mas altos potenciales de ionización y la mas alta electronegatividad.
3. Pueden obtener la estructura estable del átomo de gas noble mas próximo en la tabla periódica ganando un solo electrón,es decir, los átomos de los halógenos tienen siete electrones de valencia; y por lo consiguiente solo necesitan uno más para alcanzar el octeto estable.
4.Se presentan como moléculas diatómicas formadas mediante enlaces covalentes simples.
Flúor
Símbolo F, número atómico 9, miembro de la familia de los halógenos con el número y peso atómicos más bajos. Aunque sólo el isótopo con peso atómico 19 es estable, se han preparado de manera artificial los isótopos radiactivos, con pesos atómicos 17 y 22, el flúor es el elemento más electronegativo, y por un margen importante, el elemento no metálico más energético químicamente.
Propiedades:
El estado del flúor en su forma natural es gaseoso (no magnético). El flúor es un elmento químico de aspecto gas pálido verde-amarillo y pertenece al grupo de los halógenos. El número atómico del flúor es 9. El símbolo químico del flúor es F. El punto de fusión del flúor es de 53,53 grados Kelvin o de -218,62 grados celsius o grados centígrados. El punto de ebullición del flúor es de 85,03 grados Kelvin o de -187,12 grados celsius o grados centígrados.
Uso:
- Algunos compuestos de flúor (tal como fluoruro sódico, fluoruro estannoso y monofluorofosfato de sodio) se añaden a los dentífricos para prevenir las caries dentales. También se añaden hatibualmente al agua.
- Los anestésicos más generales son derivados de compuestos de flúor.
- El flúor-18 es un isótopo artificial que emite positrones y tiene una vida media relativamente más larga. Esto lo hace ideal para su uso en la topografía por emisión de positrones.
- Los revestimientos antireflectantes contienen compuestos de flúor.
Descubrimiento:
Henri Moissan en 1886, consiguió aislar el fluor en forma de gas amarillento verdoso, por electrolisis de una solución de fluorhidrato potásico en ácido fluorhídrico anhídrico.
Cloro


Elemento químico de número atómico 17, masa atómica 35,453 y símbolo Cl ; es un gas del grupo de los halógenos, de color amarillo verdoso y olor fuerte e irritante, peligroso en altas concentraciones, que no se halla en estado libre en la naturaleza
Propiedades:
El estado del cloro en su forma natural es gaseoso (no magnético). El cloro es un elmento químico de aspecto amarillo verdoso y pertenece al grupo de los halógenos. El punto de fusión del cloro es de 171,6 grados Kelvin o de -100,55 grados celsius o grados centígrados. El punto de ebullición del cloro es de 239,11 grados Kelvin o de -33,04 grados celsius o grados centígrados.
Uso:
- El cloro se utiliza para fabricar plásticos.
- El PVC (cloruro de polivinilo) está hecho de cloro.
- El cloro se utiliza (por lo general un determinado compuesto de cloro) para matar las bacterias en las piscinas y en el agua potable. También se utiliza en los desinfectantes y blanqueadores por la misma razón
- El cloro se utiliza en la extracción de bromo.
Descubrimiento:
Carl Wilhelm hizo reaccionar al mineral pirolusita (dióxido de magnesio MNO2) con acido clorhídrico. La reacción química produjo un gas verdoso con un olor sofocante y desagradable. Observo que blanqueaba las hojas verdes y corroía los metales Sheele pensó que este gas contenía oxigeno, fue Davy, en 1810, quien confirmo que el cloro era un elemento y le puso un nombre.
Bromo:
El bromo o bromino (también llamado antaño fuego líquido) es un elemento químico de número atómico 35. Su símbolo es Br.
Propiedades:
El estado del bromo en su forma natural es líquido, muy móvil y volátil. El bromo es un elemento químico de aspecto gas o líquido: marrón rojizo Sólido: metálico lustroso y pertenece al grupo de los halógenos. El número atómico del bromo es 35. El símbolo químico del bromo es Br. El punto de fusión del bromo es de 265,8 grados Kelvin o de -6,35 grados celsius o grados centígrados. El punto de ebullición del bromo es de 332 grados Kelvin o de 59,85 grados celsius o grados centígrados.
Usos:
- El mayor uso de bromo es la creación de retardantes de llama. Cuando cuando esta sustancia se quema el bromo aisla el fuego del oxígeno causando que este se apague.
- Los compuestos de bromuro, en particular el bromuro de potasio, se utilizan en los círculos médicos como anticonvulsivos.
- Las sustancias bromadas son ingredientes importantes de muchos medicamentos de venta libre y medicamentos con receta, como analgésicos, sedantes y los antihistamínicos.
- El bromuro procedente del calcio, sodio y zinc se utiliza para crear soluciones especiales para la perforación de sal.
- El bromo se utiliza para crear aceites vegetales bromados que se utilizan como emulsiona en algunas marcas de bebidas gaseosas.
Descubrimiento:
Francia, 1826, El químico francés Balard, que estaba trabajando con sales precipitadas del agua de los pantanos de Montpellier, descubrió que, al añadir ciertos productos químicos, aparecía una sustancia de color pardo, irritante y de olor desagradable, se comprobó que era un nuevo elemento químico: el bromo.
Astato
El ástato es un elemento químico de la tabla periódica cuyo símbolo es At y su número atómico es 85. Es radiactivo y el más pesado de los halógenos. Se produce a partir de la degradación de uranio y torio.
Propiedades:
El estado del astato en su forma natural es sólido. El astato es un elmento químico de aspecto metálico y pertenece al grupo de los halógenos. El número atómico del astato es 85. El símbolo químico del astato es At. El punto de fusión del astato es de 575 grados Kelvin o de 302,85 grados celsius o grados centígrados.
Uso:
Ya que sus isotopos tienen una vida media muy corta, no existen compuestos comercialmente importados del ástato. El ástato es un elemento muy inestable, que existe sólo en formas radiactivas de vida corta. El isótopo más importante es el 211At y se utiliza en marcaje isotópico.
Descubrimiento:
Dale Corson, K. MacKenzie, Emilio Segrè. USA, 1940, se obtuvo bombardeando el isotopo de bismuto con partículas alfa.
Yodo
El yodo o iodo es un elemento químico de número atómico 53. Su símbolo es I. forma moléculas diatómicas y por ello forma el diyodo de fórmula molecular I2.
Propiedades:
El estado del yodo en su forma natural es sólido. El yodo es un elmento químico de aspecto violeta (Gas) Gris violáceo (Sólido) y pertenece al grupo de los halógenos. El número atómico del yodo es 53. El símbolo químico del yodo es I. El punto de fusión del yodo es de 355,95 grados Kelvin o de 83,8 grados celsius o grados centígrados. El punto de ebullición del yodo es de 457,4 grados Kelvin o de 185,25 grados celsius o grados centígrados.
Uso:
El yoduro de potasio ha sido utilizado para ayudar a aquellas personas que han estado expuestas a radiación. Este compuesto reduce la acumulación dañina de sustancias radioactivas en la tiroides.
Tiene usos muy importantes en medicina. Soluciones de yodo y alcohol y complejos de yodo se utilizan como antisépticos y desinfectantes.
Isótopos radiactivos del yodo se usan en medicina nuclear como trazadores y en otros campos de investigación.
También tiene otros usos no médicos como preparación de emulsiones fotográficas, elaboración de colorantes y lámparas halógenas.
El yoduro de plata dispersado en las nubes se utiliza para producir lluvia con fines agrícolas.
Descubrimiento:
Bernard Courtois, estaba experimentando con las cenizas de algas, una buen fuente de sodio y potasio. Al tratar las cenizas con un ácido fuerte (ácido sulfúrico) para retirar los compuestos de azufre,Courtois se percato de que salia un vapor de color violeta. Al enfriarlo obtuvo unos cristales oscuros.
Bibliografia:
http://slideplayer.es/slide/1116773/
http://elementos.org.es/cloro
https://es.wikipedia.org/wiki/Bromo
http://elementos.org.es/astato
http://es.slideshare.net/10anaqa4b/el-astato
http://www.quimicaweb.net/tablaperiodica/paginas/astato.htm

El Grupo VI (actualmente 16) recibe también el nombre de Grupo del Oxígeno por ser este el primer elemento del grupo. Esta conformado por el oxigeno (O), el azufre (S), el selenio (Se), el telurio (Te) y el polonio (Po)
http://slideplayer.es/slide/1116773/
http://elementos.org.es/cloro
https://es.wikipedia.org/wiki/Bromo
http://elementos.org.es/astato
http://es.slideshare.net/10anaqa4b/el-astato
http://www.quimicaweb.net/tablaperiodica/paginas/astato.htm
Grupo VI-A

Ubicación del grupo VI-A en la tabla periódica
El Grupo VI (actualmente 16) recibe también el nombre de Grupo del Oxígeno por ser este el primer elemento del grupo. Esta conformado por el oxigeno (O), el azufre (S), el selenio (Se), el telurio (Te) y el polonio (Po)
Propiedades generales:
-Tienen seis electrones en el último nivel con la configuración electrónica externa ns2 np4.
-Los tres primeros elementos, el oxígeno, azufre y selenio son no metales y los dos últimos el telurio y polonio son metaloides.
-Los tres primeros elementos, el oxígeno, azufre y selenio son no metales y los dos últimos el telurio y polonio son metaloides.
-Ganan o ceden dos electrones al formar compuestos.
-El oxígeno es un gas diatómico. El azufre y el selenio forman moléculas octa-atómicas S8 y Se8
-El telurio y el polonio tienen estructuras tridimensionales.
-El oxígeno, azufre, selenio y telurio tienden a aceptar dos electrones formando compuestos iónicos. Estos elementos también pueden formar compuestos moleculares con otros no metales, en especial el oxígeno.
Oxigeno
El oxígeno es un elemento químico de número atómico 8 y representado por el símbolo O. forma parte del grupo de los anfígenos en la tabla periódica y es un elemento no metálico altamente reactivo que forma fácilmente compuestos con la mayoría de elementos, excepto con los gases nobles helio y neón. Asimismo, es un fuerte agente oxidante y tiene la segunda electronegatividad más alta de todos los elementos
El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono.
Propiedades:
El estado del oxígeno en su forma natural es gaseoso (paramagnético). El oxígeno es un elmento químico de aspecto incoloro y pertenece al grupo de los no metales. El número atómico del oxígeno es 8. El símbolo químico del oxígeno es O. El punto de fusión del oxígeno es de 50,35 grados Kelvin o de -221,8 grados celsius o grados centígrados. El punto de ebullición del oxígeno es de 90,18 grados Kelvin o de -181,97 grados celsius o grados centígrados.
Uso:
Constituye el 21 % de la atmósfera terrestre, es fundamental para la vida. Como oxígeno molecular (O2 ) se utiliza en la industria del acero, en el tratamiento de aguas negras, en el blanqueado de pulpa y papel, en sopletes oxiacetilénicos, en medicina y en numerosas reacciones como agente oxidante.
Descubrimiento:
Propiedades:
El estado del oxígeno en su forma natural es gaseoso (paramagnético). El oxígeno es un elmento químico de aspecto incoloro y pertenece al grupo de los no metales. El número atómico del oxígeno es 8. El símbolo químico del oxígeno es O. El punto de fusión del oxígeno es de 50,35 grados Kelvin o de -221,8 grados celsius o grados centígrados. El punto de ebullición del oxígeno es de 90,18 grados Kelvin o de -181,97 grados celsius o grados centígrados.
Uso:
Constituye el 21 % de la atmósfera terrestre, es fundamental para la vida. Como oxígeno molecular (O2 ) se utiliza en la industria del acero, en el tratamiento de aguas negras, en el blanqueado de pulpa y papel, en sopletes oxiacetilénicos, en medicina y en numerosas reacciones como agente oxidante.
Descubrimiento:
Carl Wilhelm Scheele, un químico sueco, fue el primero que lo preparó, en 1772. Identificándolo como uno de los primeros constituyentes que están en el aire, llamándolo aire de fuego y aire vitrolo.Pero a quien se considera como su descubridor es Joseph Priestley, un químico británico y ministro inglés de una iglesia en 1774, año en el que publico sus resultados sobre el descubrimiento del oxígeno.
Azufre
Azufre
Elemento químico, de número atómico 16, masa atómica 32,064 y símbolo S ; es un no metal de color amarillo pálido y olor desagradable, que se encuentra en la naturaleza tanto en forma libre como combinado con otros elementos
Propiedades:
El estado del azufre en su forma natural es sólido. El azufre es un elmento químico de aspecto amarillo limón y pertenece al grupo de los no metales. El número atómico del azufre es 16. El símbolo químico del azufre es S. El punto de fusión del azufre es de 388,36 grados Kelvin o de 116,21 grados celsius o grados centígrados. El punto de ebullición del azufre es de 717,87 grados Kelvin o de 445,72 grados celsius o grados centígrados.
Uso:
Se usa en muchos procesos industriales como la producción de ácido sulfúrico (sustancia química más importante a nivel industrial), en la fabricación de pólvora y el vulcanizado del caucho. Algunos compuestos como los sulfitos tienen propiedades blanqueadoras, otros tienen uso medicinal (sulfas, sulfato de magnesio). También se utiliza en la elaboración de fertilizantes y como fungicida
Descubrimiento:
Su descubridor es desconocido ya que se utiliza desde la antigüedad, El azufre se conoce desde los tiempos más remotos, pues con el nombre de "piedra inflamable" se menciona en la Biblia y en los documentos más antiguos. Se usaba en medicina y, los vapores producidos en su combustión, por griegos y romanos para blanquear telas.
Selenio
Es un elemento químico de la tabla periódica cuyo símbolo es Se y cuyo número atómico es 34.
El selenio se puede encontrar en varias formas alotrópicas.
Propiedades:
El estado del selenio en su forma natural es sólido. El selenio es un elmento químico de aspecto gris metálico y pertenece al grupo de los no metales. El número atómico del selenio es 34. El símbolo químico del selenio es Se. El punto de fusión del selenio es de 494 grados Kelvin o de 221,85 grados celsius o grados centígrados. El punto de ebullición del selenio es de 957,8 grados Kelvin o de 685,65 grados celsius o grados centígrados.
Uso:
Se utiliza básicamente en electricidad y electrónica, como en células solares y rectificadores. Se añade a los aceros inoxidables y es catalizador de reacciones de deshidrogenación. Algunos compuestos se emplean en la fabricación del vidrio y esmaltes. Los sulfuros se usan en medicina veterinaria y champús. El dióxido de selenio es un catalizador muy utilizado en reacciones de oxidación, hidrogenación y deshidrogenación de compuesos orgánicos.
Descubrimiento:
En 1817, Jons Berzelius se encontraba analizando muestras de cierto ácido sulfúrico preparado en una ciudad minera sueca y, encontró una impureza que creyó que se trataba de un nuevo metal. Al principio, pensó que debería tratarse del telurio, pero cuando aisló el metal, demostró ser algo más: un nuevo elemento que se parecía al telurio, este fue llamado selenio.
Telurio
El telurio o teluro es un elemento químico cuyo símbolo es Te y su número atómico es 52. Es un metaloide muy conocido
Propiedades:
El estado del telurio en su forma natural es sólido (no-magnético). El telurio es un elmento químico de aspecto gris plateado y pertenece al grupo de los metaloides. El número atómico del telurio es 52. El símbolo químico del telurio es Te. El punto de fusión del telurio es de 722,66 grados Kelvin o de 450,51 grados celsius o grados centígrados. El punto de ebullición del telurio es de 1261 grados Kelvin o de 988,85 grados celsius o grados centígrados.
Uso:
Se emplea para aumentar la resistencia a la tensión en aleaciones de cobre y plomo y en la fabricación de dispositivos termoeléctricos. También se utiliza como agente vulcanizador y en la industria del vidrio. El telurio coloidal es insecticida y fungicida.
Descubrimiento:
Fue descubierto en minerales de oro por Muller von Reichstein, inspector jefe de minas en Transilvania, en 1782. En principio se confundió con el antimonio. Fue Klaproth, en 1798, quien aisló el metal y lo llamó Telurio.
Polonio


Elemento químico de número atómico 84, masa atómica 210 y símbolo Po ; es un metal sólido radiactivo; se encuentra en los minerales que contienen radio
Propiedades:
El estado del polonio en su forma natural es sólido (no magnético). El polonio es un elmento químico de aspecto plateado y pertenece al grupo de los metaloides. El número atómico del polonio es 84. El símbolo químico del polonio es Po. El punto de fusión del polonio es de 527 grados Kelvin o de 254,85 grados celsius o grados centígrados. El punto de ebullición del polonio es de 1235 grados Kelvin o de 962,85 grados celsius o grados centígrados.
Uso:
los isótopos constituyen una fuente de radiación alfa. Se usan en la investigación nuclear. Otro uso es en dispositivos ionizadores del aire para eliminar la acumulación de cargas electrostáticas.


Elemento químico de número atómico 84, masa atómica 210 y símbolo Po ; es un metal sólido radiactivo; se encuentra en los minerales que contienen radio
Propiedades:
El estado del polonio en su forma natural es sólido (no magnético). El polonio es un elmento químico de aspecto plateado y pertenece al grupo de los metaloides. El número atómico del polonio es 84. El símbolo químico del polonio es Po. El punto de fusión del polonio es de 527 grados Kelvin o de 254,85 grados celsius o grados centígrados. El punto de ebullición del polonio es de 1235 grados Kelvin o de 962,85 grados celsius o grados centígrados.
Uso:
los isótopos constituyen una fuente de radiación alfa. Se usan en la investigación nuclear. Otro uso es en dispositivos ionizadores del aire para eliminar la acumulación de cargas electrostáticas.
Descubrimiento:
1898, Francia, Fue el primer elemento descubierto por Marie Sklodowska Curie, al intentar encontrar el origen de la radiactividad de la pechblenda de Joachimsthal (Bohemia). Se necesitaron varias toneladas del mineral pechblenda para obtener cantidades ínfimas de polonio. Aislaron el polonio mediante mediciones de la radiactividad, aquellos montones del mineral que más radiactividad emitían eran los que contenían polonio. Fue así como lo fueron concentrando hasta aislarlo.
http://quimicaparatodos.blogcindario.com/2009/08/00043-grupo-vi-a-el-grupo-del-oxigeno.html
http://quimicaparatodos.blogcindario.com/2009/08/00043-grupo-vi-a-el-grupo-del-oxigeno.html
http://elementos.org.es/telurio
Química inorgánica, Grupo V

Ubicación del grupo V en la tabla periodica
El grupo VA del Sistema Periódico, o familia del nitrógeno, está formado por los elementos: nitrógeno (N) , fósforo (P),arsénico (As), antimonio (Sb) y bismuto (Bi).
Propiedades generales:
-Sus elementos poseen 5 electrones de valencia, por lo tanto tienden a formar enlaces covalentes, y en ocasiones algunos forman enlaces iónicos (Sb y Bi). A medida que se desciende
-El carácter metálico aumenta considerablemente conforme se desciende en el grupo, siendo el nitrógeno y el fósforo no-metales, el arsénico y el antimonio semimetales y el bismuto un metal.
-El fósforo existe como como moléculas de P4, forma dos óxidos sólidos de fórmulas P4O6 y P4O10. El arsénico, antimonio y bismuto tienen estructuras tridimensionales. El bismuto es con mucho un metal mucho menos reactivo que los de los grupos anteriores.
Nitrógeno
El nitrógeno es un elemento químico de número atómico 7, símbolo N y que en condiciones normales forma un gas diatómico que constituye del orden del 78 % del aire atmosférico
Propiedades:
| |||||||||||||||||||||||||||
Uso:
Consituye el 78 % de la atmósfera terrestre. El nitrógeno diatómico se emplea para obtener amoníaco y éste en la obtención de fertilizantes. Entre las sales de ácido nítrico se destaca el nitrato de potasio (sal nitro) que se utiliza para obtener pólvora y el nitrato de amonio que se emplea como fertilizante. La hidracina es un combustible de cohetes. El trinitrotolueno y la nitroglicerina son explosivos.
Descubrimiento:
Escocia. 1772, En el estudio de la composición del aire, Joseph Black, obtuvo un gas que permitía la combustión y la vida y otro gas que no la permitía ("aire viciado"). Rutherford estudió este gas y llegó a la conclusión de que era "aire flogistizado", donde "nada ardía y nada vivía en él". Aunque no supo de qué gas se trataba, fue el primero en descubrirlo.
Fósforo
Es un elemento químico de número atómico 15 y símbolo P. Es un no metal multivalente perteneciente al grupo del nitrógeno que se encuentra en la naturaleza combinado en fosfatos inorgánicos y en organismos vivos pero nunca en estado nativo. Es muy reactivo y se oxida espontáneamente en contacto con el oxígeno atmosférico emitiendo luz.
Propiedades:
| ||||||||||||||||||||||||||||
Se encuentra formando fosfatos en la naturaleza, nunca en forma nativa. De gran importancia biológica, se presenta en tres variedades, blanco, rojo y negro. Antiguamente se utilizaba el fósforo elemental para fabricar cerillos pero actualmente fue reemplazado por el trisulfuro de tetrafosforo (P4S3). El ácido fosfórico y los fosfatos tienen muchas aplicaciones tales como fertilizantes, detergentes, dentífricos, retardadores del fuego y reguladores de acidez en bebidas carbonatadas (gaseosas).
Descubrimiento:
1669, Alemania, Buscando la piedra filosofal, Hennig Brand destiló una mezcla de arena y orina evaporada y obtuvo un cuerpo que tenía la propiedad de lucir en la oscuridad. Durante un siglo se vino obteniendo esta sustancia exclusivamente de la orina, hasta que en 1771 Scheele la produjo de huesos calcinados.
Arsénico
El arsénico es un elemento químico de la tabla periódica que pertenece al grupo de los metaloides, cuyo símbolo es As y el número atómico es 33
Se conoce desde la antigüedad y se reconoce como extremadamente tóxico.
Propiedades:
| ||||||||||||||||||||||||||||
Uso:
Su uso principal es como preservante de la madera. El arseniuro de galio se utiliza como semiconductor en circuitos integrados y en la construcción de diodos láser y LED. Es un aditivo en las aleaciones de plomo y latones y como trióxido de arsénico decolorante en la fabricación del vidrio. Algunos de sus compuestos son muy tóxicos.
Descubrimiento:
1250, Se cree que fue obtenido por Alberto Magno calentando jabón junto con oropimente (trisulfuro de diarsénico).
Antimonio
Es un elemento químico de número atómico 51 situado en el grupo 15 de la tabla periódica de los elementos.Este elemento semimetálico tiene cuatro formas alotrópicas. En su forma estable es un metal blanco azulado. El antimonio negro y el amarillo son formas no metálicas inestables.
Propiedades:
CARACTERÍSTICAS GENERALES
| |
| Nombre: Antimonio | Símbolo: Sb |
| Número atómico: 51 | Masa atómica (uma): 121,760 |
| Período: 5 | Grupo: VA (nitrogenoideos) |
| Bloque: p (representativo) | Valencias: +3, +5, -3 |
PROPIEDADES PERIÓDICAS
| |
| Configuración electrónica: [Kr] 4d10 5s2 5p3 | Radio atómico (Å): 1,45 |
| Radio iónico (Å): 0,62 (+5), 2,45 (-3) | Radio covalente (Å): 1,38 |
| Energía de ionización (kJ/mol): 834 | Electronegatividad: 2,05 |
| Afinidad electrónica (kJ/mol): 103 | |
PROPIEDADES FÍSICAS
| |
| Densidad (g/cm3): 6,697 | Color: Blanco azulado |
| Punto de fusión (ºC): 631 | P. de ebullición (ºC): 1587 |
| Volumen atómico (cm3/mol): 18,19 | |
Uso:
Tiene creciente importancia en la producción de diodos y detectores infrarrojos. Como aleante incrementa la dureza y fuerza mecánica del plomo. También se utiliza en aleaciones como el peltre, metales antifricción y metal inglés. Otros usos son en baterías y acumuladores, recubrimiento de cables y cojinetes y rodamientos. El trióxido de antimonio se usa como retardante de llama.
Descubrimiento:
Los compuestos de antimonio se conocen desde la antigüedad y, como metal, a comienzos del siglo XVII. En el antiguo Egipto se empleaba el sulfuro de antimonio como ungüento, colorete y para ennegrecer las uñas.
Bismuto
Es un elemento químico de la tabla periódica cuyo símbolo es Bi, su número atómico es 83
Propiedades:
CARACTERÍSTICAS GENERALES
| |
| Nombre: Bismuto | Símbolo: Bi |
| Número atómico: 83 | Masa atómica (uma): 208,980 |
| Período: 6 | Grupo: VA (nitrogenoideos) |
| Bloque: p (representativo) | Valencias: +3, +5, -3 |
PROPIEDADES PERIÓDICAS
| |
| Configuración electrónica: [Xe] 4f14 5d10 6s2 6p3 | Radio atómico (Å): 1,70 |
| Radio iónico (Å): 0,74 (+5), 1,20 (+3) | Radio covalente (Å): 1,46 |
| Energía de ionización (kJ/mol): 703 | Electronegatividad: 2,02 |
| Afinidad electrónica (kJ/mol): 91 | |
PROPIEDADES FÍSICAS
| |
| Densidad (g/cm3): 9,780 | Color: Blanco |
| Punto de fusión (ºC): 271 | P. de ebullición (ºC): 1564 |
| Volumen atómico (cm3/mol): 21,37 | |
Uso:
Se utiliza en algunas aleaciones y algunos de sus compuestos se emplean como cosméticos y en aplicaciones farmacéuticas. Actualmente se emplea en aleaciones reemplazando al plomo que resulta tóxico.
Descubrimiento:
Sobre el siglo XIII se confundía con el plomo y el estaño. Claude Geoffrey demostró, en 1753, que era diferente del plomo. Karl Scheele y Torbern Bergman descubrieron el bismuto como elemento.
Bibliografia:
http://quimicaparatodos.blogcindario.com/2009/08/00042-grupo-va-el-grupo-del-nitrogeno.html
http://www.quimicaweb.net/tablaperiodica/paginas/grupoVA.htm
https://es.wikipedia.org/wiki/Bismuto
Tabla periódica: Grupos y periodos

El inventor: Dmitri Mendeléyev, químico ruso (8 de febrero de 1834, Tobolsk / 2 de febrero de 1907, San Persburgo).
Mendeléyev ordenó los elementos según su masa atómica, situando en una misma columna los que tuvieran algo en común. Al ordenarlos, se dejó llevar por dos grandes intuiciones; alteró el orden de masas cuando era necesario para ordenarlos según sus propiedades y se atrevió a dejar huecos, postulando la existencia de elementos desconocidos hasta ese momento. El sistema periódico es la clasificación de todos los elementos químicos, naturales o creados artificialmente. A medida que se perfeccionaron los métodos de búsqueda, el número de elementos químicos conocidos fue creciendo sin cesar y surgió la necesidad de ordenarlos de alguna manera. Se realizaron varios intentos, pero el intento decisivo lo realizó Mendeléyev, que creó lo que hoy se denomina sistema periódico.
Componentes de las tabla periódica:
-Grupos: A las columnas verticales de la tabla periódica se las conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar. En virtud de un convenio internacional de denominación, los grupos están numerados de 1 a 18 desde la columna más a la izquierda (los metales alcalinos)
hasta la columna más a la derecha (Los gases nobles)
-Periodos: Las filas horizontales de la tabla periódica son llamadas períodos. El número de niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden:
| 1s | |||||
| 2s | 2p | ||||
| 3s | 3p | ||||
| 4s | 3d | 4p | |||
| 5s | 4d | 5p | |||
| 6s | 4f | 5d | 6p | ||
| 7s | 5f | 6d | 7p |
Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica.
Los elementos en el mismo período muestran tendencias similares en radio atómico, energía de ionización, afinidad electrónica y electronegatividad
-Los elementos se dividen en:
1. Metales: Son buenos conductores de la electricidad y el calor
2. No metales: Malos conductores de calor y de la electricidad
3. Metaloides: Presentan propiedades de metales y de no metales.
-Bloques: Es un arreglo de los elementos de acuerdo con el último subnivel que se forma.

| BLOQUE "s" | GRUPOS IA Y IIA | |
| BLOQUE "p" | GRUPOS III A al VIII A | |
| BLOQUE "d" | ELEMENTOS DE TRANSICIÓN | |
| BLOQUE "f" | ELEMENTOS DE TRANSICIÓN INTERNA |
Bibliografia:
http://genesis.uag.mx/edmedia/material/QIno/T4.cfm
https://es.wikipedia.org/wiki/Tabla_peri%C3%B3dica_de_los_elementos#Grupos
El átomo de carbono/ Quimica organica
La Química orgánica, también llamada Química del carbono, se ocupa de estudiarlas propiedades y reactividad de todos los compuestos que llevan carbono en su composición.
• Formar hasta cuatro enlaces de tipo covalente. Estos enlaces pueden ser sencillos, dobles o triples.
• Enlazarse con elementos tan variados como hidrógeno, oxígeno, nitrógeno,azufre, flúor, cloro, bromo, yodo entre otros.
• Constituir cadenas de variada longitud, desde un átomo de carbono hasta miles;lineales, ramificadas o, incluso, cíclicas.
Teoría de enlace de valencia:
la unión covalente entre dos átomos ocurre como consecuencia del solapamiento de dos orbitales atómicos (cada uno conteniendo un electrón) de parecida energía y adecuada orientación espacial. Por tanto, se produce el apareamiento de dos electrones que se localizan entre los núcleos de ambos átomosa) Enlace covalente simple: Cada átomo aporta un electrón al enlace, es decir, se comparte un par de electrones entre dos átomos. Un ejemplo es la molécula de Hidrógeno (H2):
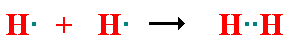
b) Enlace covalente doble: Cada átomo aporta dos electrones al enlace, es decir, se comparten dos pares de electrones entre dos átomos. Un ejemplo es la molécula de Oxígeno (O2):
c) Enlace covalente triple: Cada átomo aporta tres electrones al enlace, es decir, se comparten tres pares de electrones entre dos átomos, por ejemplo, la molécula de Nitrógeno (N2).
Bibliografia:
https://alojamientos.uva.es/guia_docente/uploads/2011/472/45938/1/Documento9.pdf
http://www.iesrdelgado.org/tomasgomez/2%C2%BA%20Bachillerato/QUIMICA/enlace%20covalente/punto3b.htm



https://alojamientos.uva.es/guia_docente/uploads/2011/472/45938/1/Documento9.pdf
http://www.iesrdelgado.org/tomasgomez/2%C2%BA%20Bachillerato/QUIMICA/enlace%20covalente/punto3b.htm
Propiedades del átomo de carbono
Es un elemento químico de número atómico 6 y símbolo C. Como miembro del grupo de loscarbonoideos de la tabla periódica de los elementos. Es sólido a temperatura ambiente. Dependiendo de las condiciones de formación, puede encontrarse en la naturaleza en distintas formas alotrópicas
| Propiedades | ||
|---|---|---|
| Símbolo químico | C | |
| Número atómico | 6 | |
| Grupo | 14 | |
| Periodo | 2 | |
| Aspecto | negro (grafito) Incoloro (diamante) | |
| Bloque | p | |
| Densidad | 2267 kg/m3 | |
| Masa atómica | 12.0107 u | |
| Radio medio | 70 pm | |
| Radio atómico | 67 | |
| Radio covalente | 77 pm | |
Características:
-Pueden presentarse de forma dura como diamante y en forma blanda como el grafito.
-Presenta una gran afinidad para enlazarse con otros átomos pequeños y así formar cadenas y gracias a su pequeño radio puede formar enlaces múltiples
Ej: CO2, formado por el oxigeno y los hidrocarburos con el hidrógeno
Estados alotrópicos: amorfo, diamante, fulerenos y nanotubos
-Amorfo: Es esencialmente grafito, pero no llega a adoptar una estructura cristalina macroscopica.

-Fulereno: Se forman cuando el grafito se vaporiza en un láser. Esta es una variedad de grupos, grandes que tienen un núcleo constante de átomos de carbono.

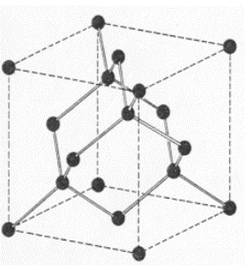
-El diamante: tiene una estructura de cristal covalente tridimensional, que se encuentra formado por enlaces C-C interconectados, extendiéndose a través de todo el cristal, por lo que se dice que el diamante es una molécula gigante

-Nanotubos: Su estructura puede considerarse procedente de una lámina de grafito enrolladas sobre sí misma.

Aplicaciones:
- El uso principal de carbono es en forma de hidrocarburos, principalmente gas metano y el petróleo crudo. El petróleo crudo se utiliza para producir gasolina y queroseno a través de su destilación.
- La celulosa, un polímero de carbono natural que se encuentra en plantas, se utiliza en la elaboración de algodón, lino y cáñamo.
- Los plásticos se fabrican a partir de polímeros sintéticos de carbono.
- El grafito, una forma de carbono, se combina con arcilla para hacer el principal componente de los lápices. El grafito se utiliza también como un electrodo en la electrólisis, ya que es inerte (no reacciona con otros productos químicos).
- El grafito se utiliza también como lubricante, como pigmento, como un material de moldeo en la fabricación de vidrio y como moderador de neutrones en los reactores nucleares.
Características del átomo de carbono
- En cuanto al número y variedad de forma de los compuestos químicos que constituyen, muchos de ellos son la base de la materia viva.
- Constituye el 0.08% de la litósfera, hidrósfera y atmósfera combinadas.
- En la corteza terrestre se encuentra principalmente en el carbón de piedra, el petróleo y el gas natural.
- A temperaturas superiores a los 3600°C se sublima, es decir pasa de estado sólido a vapor.
- En metalurgia se aprovecha su poder de combinación con el oxígeno, pues es reductor y sustraer el oxígeno de los óxidos metálicos para combinarse con el, dejando el metal libre.
- Con algunos metales se combina para formar los carburos, como el carburo de calcio (CaC2), el carburo de aluminio (Al4C3)
- Con el silicio, forma el carburo de silicio (SiC) llamado carburundum, sustancia mas dura que se conoce.
Bibliografia:
http://quimica.laguia2000.com/quimica-inorganica/formas-alotropicas-del-carbono
https://es.wikipedia.org/wiki/Nanotubo
http://www.fullquimica.com/2012/08/caracteristicas-del-carbono.html
Suscribirse a:
Entradas (Atom)